营养与健康所等发现FTO促进肝脏脂肪生成和NAFLD发病的关键机制
N6-甲基腺苷(m6A)是丰富的表观遗传修饰,至少分布在四分之一的哺乳动物mRNA中,在各种生理病理过程中调控mRNA代谢。m6A修饰由一组名为甲基转移酶(Writer)和去甲基酶(Eraser)的酶动态控制。m6A修饰可被甲基阅读蛋白(Reader)识别。FTO是通过全基因组关联研究(GWAS)鉴定的肥胖易感基因。有研究发现啮齿动物和NAFLD患者的脂肪肝中FTO表达水平增加。尽管FTO参与调节肝脏脂肪生成,但FTO在肝脏脂肪生成中的生理病理作用尚不完全清楚。
研究发现,小鼠非酒精性脂肪肝中,总RNA m6A甲基化减少,并伴随着FTO表达的增加。肝脏过表达FTO在体内和体外均能促进脂肪变性。在肝细胞中,FTO过表达能特异性地上调负责脂肪生成的基因,但不影响参与脂肪酸摄取/氧化或脂蛋白输出的基因。从机制上讲,FTO可以通过m6A去甲基化来稳定SREBF1和ChREBP的mRNA,导致其蛋白质水平增加。胰岛素治疗在体内和体外均可增加FTO表达。抑制FTO的去甲基化酶活性可以降低SREBF1、ChREBP以及脂肪生成基因的表达,从而改善小鼠脂肪肝中TG的积累。该研究发现了“胰岛素/FTO/SREBP1c/ChREBP/脂肪生成”信号通路,巩固了FTO是NAFLD重要贡献者的结论。FTO通过去甲基酶活性,在肝脏脂肪代谢中增加了一层动态的基因表达调控机制。靶向肝脏FTO作为治疗NAFLD的策略,在未来值得进一步探讨。
研究工作获得科技部和国家自然科学基金的资助,并获得营养与健康所公共技术平台和动物平台的支持。
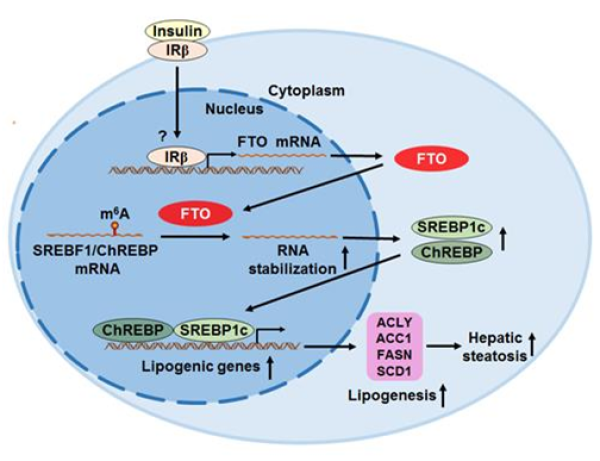
FTO信号通路示意图(注:胰岛素刺激肝细胞后,FTO的表达增加。FTO可以通过m6A去甲基化来稳定SREBF1和ChREBP的mRNA,致使其蛋白质水平增加,最终促进肝脏脂肪生成,导致肝脏脂肪变性。)
